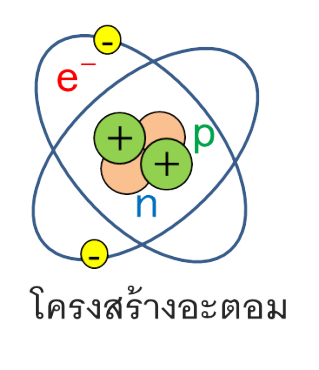
โครงสร้างอะตอม อะตอมเป็นหน่วยพื้นฐานของสสาร ประกอบด้วยนิวเคลียสหนาแน่นมากที่ศูนย์กลาง ล้อมรอบด้วยเมฆอิเล็กตรอนที่มีประจุลบ นิวเคลียสที่มีประจุบวกประกอบด้วยอนุภาค โปรตอนและนิวตรอนที่มีประจุบวกที่เป็นกลางทางไฟฟ้า อิเล็กตรอนของอะตอมถูกดึงดูดไปยังนิวเคลียสโดยแรงแม่เหล็กไฟฟ้า
นั่นคือคำจำกัดความของอะตอม กล่าวกันว่าประกอบด้วยอนุภาคพื้นฐานสามตัว: โปรตอน นิวตรอน และอิเล็กตรอน แต่คุณรู้หรือไม่ว่าก่อนที่คุณจะได้คำจำกัดความข้างต้น นักวิทยาศาสตร์ได้ศึกษาอะตอมมานานกว่า 2,000 ปีแล้ว การศึกษาอะตอมนี้เริ่มต้นโดยนักปรัชญาชาวกรีก Democritus ระหว่าง 83 ถึง 173 AD ในที่สุดก็ได้หน่วยย่อยที่ไม่สามารถแบ่งออกเป็นหน่วยย่อยที่เล็กกว่าได้ หน่วยย่อยนี้เรียกว่าอะตอม

โครงสร้างอะตอม อะตอมเป็นหน่วยพื้นฐานของสสาร ประกอบด้วยนิวเคลียสหนาแน่นมากที่ศูนย์กลาง ล้อมรอบด้วยเมฆอิเล็กตรอนที่มีประจุลบ นิวเคลียสที่มีประจุบวกประกอบด้วยอนุภาค โปรตอนและนิวตรอนที่มีประจุบวกที่เป็นกลางทางไฟฟ้า อิเล็กตรอนของอะตอมถูกดึงดูดไปยังนิวเคลียสโดยแรงแม่เหล็กไฟฟ้า
นั่นคือคำจำกัดความของอะตอม กล่าวกันว่าประกอบด้วยอนุภาคพื้นฐานสามตัว: โปรตอน นิวตรอน และอิเล็กตรอน แต่คุณรู้หรือไม่ว่าก่อนที่คุณจะได้คำจำกัดความข้างต้น นักวิทยาศาสตร์ได้ศึกษาอะตอมมานานกว่า 2,000 ปีแล้ว การศึกษาอะตอมนี้เริ่มต้นโดยนักปรัชญาชาวกรีก Democritus ระหว่าง 83 ถึง 173 AD ในที่สุดก็ได้หน่วยย่อยที่ไม่สามารถแบ่งออกเป็นหน่วยย่อยที่เล็กกว่าได้ หน่วยย่อยนี้เรียกว่าอะตอม
โครงสร้างอะตอม เซอร์ จอห์น ดาลตัน ( Sir John Dalton ) นักวิทยาศาสตร์ชาวอังกฤษที่อาศัยอยู่ระหว่างปี ค.ศ. 1766-1844 เป็นคนแรกที่เสนอทฤษฎีอะตอม เรียกว่าทฤษฎีอะตอมของดาลตัน ซึ่งมีความสำคัญดังนี้
Eugen Goldstein นักวิทยาศาสตร์ชาวเยอรมันที่อาศัยอยู่ระหว่างปี 1850 ถึง 1930 ค้นพบรังสีที่มีประจุบวก โดยการปรับเปลี่ยนหลอดรังสีแคโทดโดยทดลองกับก๊าซต่างๆ อนุภาคที่มีประจุบวกเหล่านี้ถูกพบว่ามีอัตราส่วนประจุต่อมวล (e/m) ที่ไม่เสถียร ส่งผลให้อนุภาคที่มีประจุบวกมีค่าเท่ากับอนุภาคลบ อนุภาคบวกที่เกิดจากก๊าซไฮโดรเจนถูกเรียกว่าโปรตอนในภายหลัง
เซอร์โจเซฟ จอห์น ทอมสัน (1856 – 1940) ทดลองเพิ่มอิเล็กโทรดแนวตั้งสองอัน ด้วยหลอดรังสีแคโทดดัดแปลง พบว่าตำแหน่งของจุดสว่างมุ่งตรงไปยังขั้วบวกของสนามไฟฟ้า และเมื่อเปลี่ยนชนิดของก๊าซที่บรรจุอยู่ในท่อและโลหะที่ใช้เป็นแคโทด พบว่ารังสีที่เกิดขึ้นยังคงพุ่งตรงไปยังขั้วบวกเช่นเดิม เมื่อคำนวณอัตราส่วนประจุต่อมวล พบว่ามีค่าเท่ากับ 1.76 x 108 คูลอมบ์ต่อกรัม ทุกครั้งโดยไม่คำนึงถึงชนิดของก๊าซที่ใช้ จากการทดลองและการคำนวณเหล่านี้ Thomson สรุปว่าอะตอมทั้งหมดประกอบด้วยอนุภาคที่มีประจุลบ อนุภาคนี้เรียกว่าอิเล็กตรอน
จากผลการทดลองของ Goldstein และ Thomson ได้ข้อมูลเพิ่มเติมเกี่ยวกับอะตอม “อะตอมทรงกลมประกอบด้วยอะตอมที่มีประจุบวกและอิเล็กตรอนที่มีประจุลบกระจัดกระจาย อะตอมในสถานะเป็นกลางทางไฟฟ้ามีจำนวนประจุบวกเท่ากับจำนวนประจุลบ” แบบจำลองอะตอมของทอมสัน นี่เป็นก้าวสำคัญในการศึกษาอะตอมจากดาลตัน และถือได้ว่าทอมสันเป็นคนแรกที่เสนอรายละเอียดภายในอะตอม ส่งผลให้ภาพอะตอมชัดเจนขึ้น แบบจำลองอะตอมของทอมสันไม่สามารถให้คำอธิบายที่ครอบคลุมเกี่ยวกับโครงสร้างของอะตอมได้
นักวิทยาศาสตร์ชาวเยอรมัน ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด และฮันส์ ไกเกอร์ ศึกษาและพิสูจน์แบบจำลองอะตอมของทอมสันในปี 1911 โดยการยิงอนุภาคแอลฟาที่มีประจุบวกลงบนแผ่นทองคำบางๆ และใช้หน้าจอเรืองแสงเพื่อเคลือบ ด้วยซิงค์ซัลไฟด์ส่วนโค้งล้อมรอบด้วยแผ่นทองคำเพื่อตรวจจับอนุภาคแอลฟา จากผลการทดลองพบว่าส่วนใหญ่มีแผ่นทองคำเปลว บางครั้งก็มีประกายไฟที่ด้านข้าง แล้วไฟหน้าก็ไม่สว่าง

จากผลการทดลองของ Goldstein และ Thomson ได้ข้อมูลเพิ่มเติมเกี่ยวกับอะตอม “อะตอมทรงกลมประกอบด้วยอะตอมที่มีประจุบวกและอิเล็กตรอนที่มีประจุลบกระจัดกระจาย อะตอมในสถานะเป็นกลางทางไฟฟ้ามีจำนวนประจุบวกเท่ากับจำนวนประจุลบ” แบบจำลองอะตอมของทอมสัน นี่เป็นก้าวสำคัญในการศึกษาอะตอมจากดาลตัน และถือได้ว่าทอมสันเป็นคนแรกที่เสนอรายละเอียดภายในอะตอม ส่งผลให้ภาพอะตอมชัดเจนขึ้น แบบจำลองอะตอมของทอมสันไม่สามารถให้คำอธิบายที่ครอบคลุมเกี่ยวกับโครงสร้างของอะตอมได้
นักวิทยาศาสตร์ชาวเยอรมัน ลอร์ดเออร์เนสต์ รัทเทอร์ฟอร์ด และฮันส์ ไกเกอร์ ศึกษาและพิสูจน์แบบจำลองอะตอมของทอมสันในปี 1911 โดยการยิงอนุภาคแอลฟาที่มีประจุบวกลงบนแผ่นทองคำบางๆ และใช้หน้าจอเรืองแสงเพื่อเคลือบ ด้วยซิงค์ซัลไฟด์ส่วนโค้งล้อมรอบด้วยแผ่นทองคำเพื่อตรวจจับอนุภาคแอลฟา จากผลการทดลองพบว่าส่วนใหญ่มีแผ่นทองคำเปลว บางครั้งก็มีประกายไฟที่ด้านข้าง แล้วไฟหน้าก็ไม่สว่าง
โครงสร้างอะตอม เมื่อกล่าวถึงในที่นี้ จะเห็นได้ว่าการศึกษาอะตอมทำให้นักวิทยาศาสตร์ทราบว่าอะตอมประกอบด้วยอิเล็กตรอนและโปรตอน ตามแบบจำลองของรัทเทอร์ฟอร์ด มวลอะตอมคือมวลของนิวเคลียส ถ้านิวเคลียสประกอบด้วยโปรตอนเพียงตัวเดียว มวลของนิวเคลียสน่าจะเป็นมวลรวมของโปรตอน แต่จากการทดลองพบว่า มวลของธาตุส่วนใหญ่เป็นสองเท่า หรือมากกว่ามวลรวมของโปรตอนทั้งหมดที่รวมเข้าด้วยกัน รัทเทอร์ฟอร์ดจึงสันนิษฐานว่าอาจมีอนุภาคอื่นในนิวเคลียส และอนุภาคนั้นควรมีมวลใกล้กับมวลของโปรตอนและเป็นกลางทางไฟฟ้า และการทดลองของทอมสันในปี 1913 ก็สนับสนุนแนวคิดนี้เช่นกัน เมื่อเขาศึกษามวลของอนุภาคบวกของก๊าซนีออนที่บรรจุอยู่ในหลอดรังสีแคโทด เขาพบว่าอนุภาคบวกมีมวลสองก้อน คือ 20 และ 22 ซึ่งบ่งชี้ว่านีออนประกอบด้วยอะตอมสองอะตอมที่มีมวลไม่เท่ากัน
อะตอม คืออะไร ต่อมาในปี พ.ศ. 2475 เซอร์เจมส์ ซัดวิกได้ทดลองยิงอนุภาคแอลฟาเข้าไปในอะตอมของธาตุต่างๆ และทดสอบผลลัพธ์ด้วยเครื่องมือที่มีความแม่นยำสูง ตรวจสอบให้แน่ใจว่ามีอนุภาคที่เป็นกลางทางไฟฟ้าที่เรียกว่านิวตรอนในนิวเคลียส “อะตอมประกอบด้วยอนุภาคพื้นฐานสามชนิด ได้แก่ อิเล็กตรอน โปรตอน และนิวตรอน”
แต่แบบจำลองอะตอมของรัทเทอร์ฟอร์ด ยังไม่สามารถอธิบายได้ว่าอิเล็กตรอนล้อมรอบนิวเคลียสอย่างไร นักวิทยาศาสตร์ได้ศึกษา วิจัย ทดลอง จนกระทั่งได้แบบจำลองอะตอมของบอร์ “อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสในวงโคจรที่คล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงมีระดับพลังงานของตัวเอง ระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสมากที่สุดและมีพลังงานน้อยที่สุดเรียกว่าระดับ K ระดับพลังงานถัดไปคือ L M N ตามลำดับ” อะตอมและพันธะเคมี

แบบจําลองอะตอม สรุป เพื่ออธิบายการเปลี่ยนแปลงของสารก่อนและหลังปฏิกิริยา รวมทั้งอัตราส่วนมวลของธาตุที่ประกอบเป็นสารประกอบ ซึ่งสามารถสรุปได้ดังนี้
จอห์น ดาลตัน ชาวอังกฤษ เสนอทฤษฎีอะตอม
แบบจําลองอะตอม ดอลตัน ทฤษฎีอะตอมของดาลตันอธิบายเฉพาะธรรมชาติและคุณสมบัติของอะตอมเท่านั้น แต่ต่อมานักวิทยาศาสตร์ได้ค้นพบข้อมูลดังกล่าว บางสิ่งไม่สอดคล้องกับทฤษฎีอะตอมของดาลตัน ตัวอย่างเช่น อะตอมของธาตุเดียวกันอาจมีมวลต่างกัน

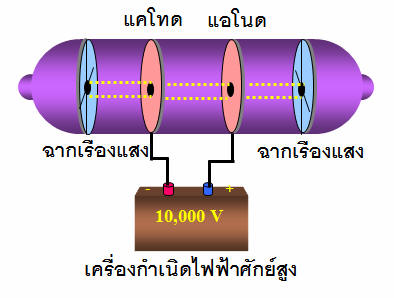
เซอร์ โจเซฟ จอห์น ทอมสัน (เจ.เจ. ทอมสัน) นักวิทยาศาสตร์ชาวอังกฤษ สนใจปรากฏการณ์ที่เกิดขึ้นในหลอดรังสีแคโทด การทดลองการนำก๊าซดำเนินการในปี พ.ศ. 2440 ทอมสันศึกษาแนวคิดที่ว่าก๊าซสามารถนำไฟฟ้าได้ หากเงื่อนไขถูกต้อง กล่าวคือ เงื่อนไขนั้นมีความต่างศักย์สูงมาก และแรงดันต่ำโดยใช้หลอดแก้วสุญญากาศ ประกอบด้วยวงจรไฟฟ้ากระแสตรงที่มีความต่างศักย์ 10,000 โวลต์ อิเล็กโทรดที่เชื่อมต่อกับขั้วบวกเรียกว่าขั้วบวกและขั้วลบเรียกว่าขั้วลบ ลำแสงถูกส่งตรงจากแคโทดไปยังแอโนดที่เรียกว่ารังสีแคโทด
ในปี พ.ศ. 2438 หลังจากที่ทอมสันค้นพบอิเล็กตรอน (โดยการกำหนดประจุมวลของอนุภาคในรังสีแคโทด) และเชื่อว่าอะตอมสามารถแยกออกจากกันได้ ด้วยอิเล็กตรอนที่ประกอบเป็นอะตอม Thomson ได้สร้างแบบจำลองอะตอม แบบจำลองอะตอมของทอมสันมีลักษณะดังนี้:
แบบจําลองอะตอม คือ อย่างไรก็ตาม แบบจำลองอะตอมของทอมสัน มีข้อบกพร่องหลายประการเช่น
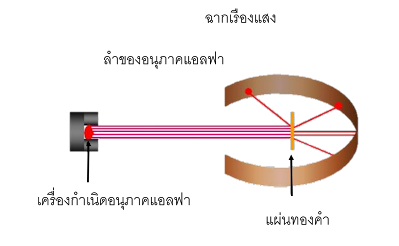
แบบจําลองอะตอม รัทเทอร์ฟอร์ด ในปี 1909 Rutherford ได้ทำการทดลองกับ Hans Geiger และ Ernest Marden เพื่อตรวจสอบว่าอนุภาคกัมมันตภาพรังสีอัลฟาสลายตัวและอนุภาคที่มีประจุบวกถูกยิงลงบนแผ่นทองคำบาง ๆ โดยใช้แบบจำลองอะตอมหรือไม่ โปรตอนสีทองกระจัดกระจายไปทั่วอะตอม พวกเขาผลักกันในการเคลื่อนไหว ของอนุภาคแอลฟาน่าจะเบี่ยงเบนไปจากเส้นเดิมมากที่สุด มีน้อยเคลื่อนที่เป็นเส้นตรง แต่ไม่มีอนุภาคแอลฟาสะท้อนกลับมา
เป็นผลให้อนุภาคแอลฟาส่วนใหญ่เดินทางเป็นเส้นตรง แทบไม่มีการเบี่ยงเบนไปในทิศทางใดๆ และมักมีเสียงก้องกังวาน
สรุปผลการทดลอง
อะตอมประกอบด้วยนิวเคลียสที่มีโปรตอนมาบรรจบกันที่ศูนย์กลาง นิวเคลียสมีขนาดเล็ก แต่มีมวลมากและมีประจุบวก อิเล็กตรอนที่มีประจุลบขนาดเล็กมากวิ่งรอบนิวเคลียสเป็นวงกลมกว้าง
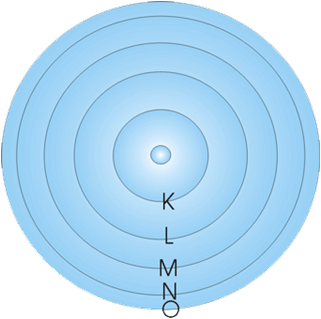
โครงสร้างอะตอม นักวิทยาศาสตร์ได้พยายามศึกษาอะตอม มันเสนอแบบจำลองอะตอมตามการทดลองที่เกิดขึ้น ยอมรับแบบจำลองของ Rutherford แล้ว แต่ยังไม่สมบูรณ์ จึงมีคนพยายามหาคำอธิบายเพิ่มเติม ในปี 1913 Neil Bohr (Niels Bohr) นักวิทยาศาสตร์ชาวเดนมาร์ก มีการศึกษาสเปกตรัมของก๊าซไฮโดรเจน และสร้างแบบจำลองอะตอมเพื่ออธิบายการเคลื่อนที่ของอิเล็กตรอนรอบนิวเคลียสในวงโคจรที่คล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ แต่ละวงมีระดับพลังงานของตัวเอง และเรียกระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้กับนิวเคลียสมากที่สุด ระดับพลังงานต่ำสุดเรียกว่าระดับพลังงาน K และระดับพลังงานถัดไปเรียกว่าระดับพลังงาน L,M,N…ตามลำดับ
แบบจําลองอะตอม ของโบร์ วิธีทำการทดลอง เขาศึกษาสเปกตรัมรังสีของธาตุ ประกอบด้วยก๊าซไฮโดรเจนในท่อระบายน้ำ สเปกตรัมคือกลุ่มของแถบสีหรือเส้นสีที่ได้จากการส่งพลังงานรังสีไปยังสเปกโตรสโคป ทำให้พลังงานรังสีแยกออกเป็นแถบหรือเส้น ที่มีความยาวคลื่นต่างกัน ผลลัพธ์: อิเล็กตรอนเคลื่อนที่จากแอโนดไปยังแคโทดชนกับก๊าซไฮโดรเจน จากนั้นแสงจะส่องผ่านปริซึม ซึ่งช่วยให้เรามองเห็นเส้นสเปกตรัมของสีต่างๆ นอกจอได้ สรุปผลการทดลอง การปล่อยไฮโดรเจน เกิดจากการที่อิเล็กตรอนเปลี่ยนระดับพลังงานจากวงโคจรสูงไปเป็นวงโคจรต่ำ พร้อมทั้งปล่อยพลังงานออกมาในรูปของแสงสีต่างๆ สารและสมบัติของสาร
เครดิตฟรี 100 กดรับเอง ยืนยันเบอร์ สล็อตเว็บตรง ไม่ผ่านเอเย่นต์ ล่าสุด รวมทุกค่ายสล็อต เปิดให้บริการความสนุก 24 ชั่วโมง ผ่านทางเข้าเล่น สล็อตเว็บใหญ่ ที่สุด อันดับ 1